一、滴定曲线与指示剂的选择
(一)强碱滴定强酸
强碱滴定强酸时发生的反应为

上述反应的平衡常数为Kt为

现以0.1000mol·L-1NaOH溶液滴定20.00mL,0.1000mol·L-1HCL.溶为例,讨论滴定过程中溶液pH值的变化情况。
1.滴定前
溶液[H+]等于HCL的初始浓度:
[H+]=c(HCl)=0.100mol.L-1
pH=-lg[H+]=1.00
2.化学计量点前
溶液的[H+]决定于剩余HCL的浓度
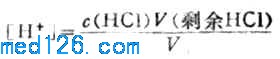
例如,当滴入18.00mLNaOH溶液时,有90%的HCL被中和,剩余HCL物质的量为0.1000×20.00-0.1000×18.00=0.2000mmol,此时溶液的总体积为38.00mL,则溶液的[H+]为:
[H+]=0.2000/38.00=5.3*10-3(mol.L-1)
pH=-lg[H+]=-lg5.3*10-3=2.28
用类似的方法可求得当加入19.98mL NaOH时溶液的PH值为4.30。
3.化学计量点时
当加入20.00mLNaOH溶液时,HCL溶液被100%的中和,变成了中性的NaCL水溶液,故溶液的PH值由水的离解决定。
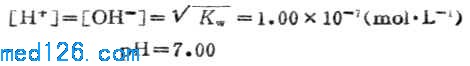
4.化学计量点后
溶液的PH值由过量的NaOH的量和溶液的总体积决定。即
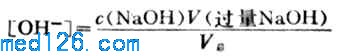
例如,当加入20.02ml NaOH溶液时, NaOH溶液过量0.02ml,溶液的总体积为40.02ml,则溶液的[OH-]为:

pOH=4.30
pH=14.00-4.30=9.70
根据上述方法可以计算出不同滴定点时溶液的PH值,部分结果列于表7-1。根据表中的数据作图,即可得到强碱滴定强酸的滴定曲线图7-1中的a。 医学 全在.线提供www.med126.com

图7-1 NaOH与HCL的滴定曲线
c(NaOH)=c(HCl) =0.1000mol.L-1
图7-1
表7-1 用NaOH滴定HCL时溶液PH的变化(c(NaOh )=c(HCL)=0.1000mol·L-1)
|
V(加入NaOH) |
被滴定HCL的百分含量% |
V(剩余HCL) |
V(过量NaOH)ml |
[H3O+] |
PH |
|
0 |
0 |
20.00 |
|
1.00×10-1 |
1.00 |
|
19.00 |
90.00 |
2.00 |
|
5.26×10-3 |
2.28 |
|
19.80 |
99.00 |
0.20 |
|
5.02×10-4 |
3.30 |
|
19.98 |
99.90 |
0.02 |
|
5.00×10-5 |
4.30 |
|
20.00 |
100.00 |
0.00 |
|
1.00×10-7 |
7.00 |
|
20.02 |
100.1 |
|
0.02 |
2.00×10-10 |
9.70 |
|
20.20 |
101.0 |
|
0.20 |
2.01×10-11 |
10.70 |
滴定曲线不仅说明了滴定时溶液PH值的变化方向,而且也说明了各个阶段的变化速度。从图中可以看出,曲线自左至右明显分成三段。前段和后段比较平坦。溶液的PH值变化缓慢,中段曲线近乎垂直。在化学计量点附近PH值有一个突变过程。这种PH值突变称之为滴定突跃,突跃所在的PH值范围称为滴定突跃范围(常用化学计量点前后各0.1%的PH范围表示,本例的突跃范围是(4.30-9.70)。
最理想的指示剂应该能恰好在反应的化学计量点发生颜色变化,但在实际工作中很难使指示剂的变色范点和化学计量点完全统一。因此,指示剂的选择主要以滴定的突跃范围为依据,通常选取变色范围全部或部分处在突跃范围内的指示剂滴定终点,这样产生的疑点误差不会超过±0.1%。在上述滴定中,甲基橙(PH3.1-4.4)和酚酞(PH8.0-10.0)的变色范围均有一部分在滴定的突跃范围内,所以都可以用来指示这一滴定疑点此外,甲基红、溴酚蓝和溴百里酚蓝等也可用作这类滴定的指示剂。
滴定突跃的大小与溶液的浓度密切相关。若酸碱浓度均增大10倍,滴定突跃范围将加宽2个PH单位;反之,若酸碱浓度减小10倍,相应的突跃范围将减小2个PH单位。可见浓度愈高突跃范围越大,浓度越低突跃范围越小,如果滴定时所用的酸碱浓度相等并小于2×10-4mol ·L-1,滴定突跃范围就会小于0.4个PH单位,用一般的指示剂就不能准确地指示出终点。故将c≥2×10-4mol ·L-1作为此类滴定能够准确进行的条件。
强酸滴定强碱的滴定曲线如图7-1中的曲线b所示。指示剂的选择及滴定反应用及其滴定条件等与前述滴定相似。