配位键理论又叫配价键理论,其基本要点可归纳为三点:
1.中心离子和配位原子间是以配价键结合的,具有孤对电子的配位原子提供电子对,填入中心离子的外层空轨道形成配位键。
2.中心离子所提供的空轨道在与配位原子成键时必须经杂化,形成数目相等的杂化轨道。这些杂化轨道的能量相同,而且有一定的方向性。它们分别和配位原子的孤对电子轨道在一定方向上彼此接近,发生最大的重叠而形成配位键,这样就形成了各种不同的配位数和不同构型的配合物。
3.中心离子的空轨道杂分时,若有次外层d轨道参加,则形成的配合物属内轨型;若均为最外层轨道参加杂化,则形成的配合物属外轨型。内轨型配合物的配位键更具有共价键性质所以叫共价配键,外轨型配合物的配位键更具有离子键性质所以叫电价配键,但本质上两者均属共价键范畴。
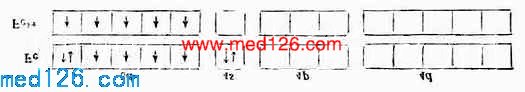
例1 [Ni{CH}4]2- Ni 原子和Ni2+的价电子层结构分别是3d84s2和3d3。
 在Ni2+的外层电子中,有两上自旋方向上相同的未成对电子,故具顺磁性。但当它与四个CN-形成[Ni{CN}4]2-配合后却具反磁性,说明配离子中已无未成对电子。配位键理论认为:原在3d轨道中的两个未成对电子合并在一个3d轨道上,空出一个3d轨道和外层的一个4s轨道及二个4p轨道杂化形成四个等价的dsp2杂化轨道所构成的配离子属内轨型配合物,它的磁性比简单离子(Ni2+)的磁性小,它的外层电子结构为:
在Ni2+的外层电子中,有两上自旋方向上相同的未成对电子,故具顺磁性。但当它与四个CN-形成[Ni{CN}4]2-配合后却具反磁性,说明配离子中已无未成对电子。配位键理论认为:原在3d轨道中的两个未成对电子合并在一个3d轨道上,空出一个3d轨道和外层的一个4s轨道及二个4p轨道杂化形成四个等价的dsp2杂化轨道所构成的配离子属内轨型配合物,它的磁性比简单离子(Ni2+)的磁性小,它的外层电子结构为:
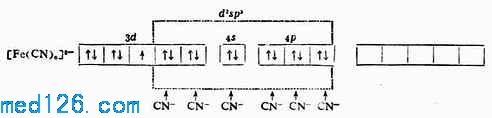
 例2 [Fe(CN)6]3- Fe原子和Fe 3+的价电子层结构分别是3d6,4s2,3d5。
例2 [Fe(CN)6]3- Fe原子和Fe 3+的价电子层结构分别是3d6,4s2,3d5。
[Fe(CN)6]3-配离子中的Fe 3+在配位体CN-的影响下,把原来分布在5个3d轨道上的5个未成对电子挤到3个3d轨道上,空出2个3d轨道与外层的1个4s轨道和3个4p轨道杂化成6个等价的d2sp3杂化轨道与6个配位体CN-成键,形成的[Fe(CN)6]3-配离子属内轨型。在与离子中只有1个未成对电子,故它的磁性比Fe 3+的磁性小,它的外层电子结构为:
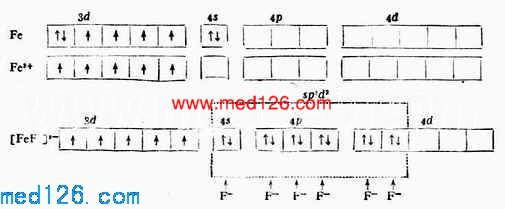
例3 [FeF6]3-
当Fe 3+和6个F-形成[FeF6]3-配离子时,磁矩未变,说明配离子中仍保留有5个未成对电子。配位键理论认为:Fe 3+利用外层的一个4 s 轨道、3个4p轨道和2个4d轨道与6个配位体F-成键,故所形成的[FeF6]3-配离子属外轨型,它的外层电子结构为:
①原子或离子的磁矩μ与原子中未成对电子数n有如下近似关系:
 式中μ以玻尔磁子(BM)为单位
式中μ以玻尔磁子(BM)为单位
(1BM=eh/2m)