如果在硫酸铜溶液中加入氨水,首先可得到浅蓝色碱式硫酸铜[Cu(OH)2]SO4沉淀,继续加入氨水,则沉淀溶解而得到深蓝色溶液。显然由于加入过量的氨水,NH3分子与Cu2+离子间已发生了某种反应。
经研究确定,在上述溶液中生成了深蓝色的复杂离子[Cu(NH3)4]2+。从溶液中还可结晶出深蓝色[[Cu(NH3)4]SO4晶体。这说明CuSO4溶液与过量氨水发生了下列反应:

或离子方程式
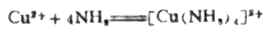
已知NaCN,KCN有剧毒,但是亚铁氰化钾(K4 [Fe(CN)6])和铁氰化钾(K3[Fe(CN)6])虽然都含有氰根,却没有毒性,这是因为亚铁离子或铁离子与氰根离子结合成牢固的复杂离子,失去了原有的性质。
[Fe(CN)6])和铁氰化钾(K3[Fe(CN)6])虽然都含有氰根,却没有毒性,这是因为亚铁离子或铁离子与氰根离子结合成牢固的复杂离子,失去了原有的性质。
由一个阳离子(如Cu2+或Fe3+)和几个中性分子(如NH3)或阴离子(如CN-)以配价键结合而成的,具有一定特性的复杂粒子,其带有电荷的叫配离子或络离子,其不带电荷的叫配合分子或络合分子。配合分子或含有配离子的化合物叫配合物。例如:[Cu(NH3)4]SO4,K4[Fe(CN)6],K3[Fe(CN)6],K2[HgI4],[Ag(NH3)2]NO3,[Pt(NH3)2CL4],[Co(NH3)5(H2O)]CL3等都是配合物。
二、配合物的组成
(一)中心离子
中心离子也称配合物的形成体,它是配合物的核心部分,位于配离子(或分子)的中心,一般都是带正电荷的,具有空的价电子轨道的阳离子。例如,上例中的Cu2+,Fe3+,Pt4+等。中心离子绝大数都是金属离子。其中的过渡金属离子是较强的配合物形成体。
(二)配位体
在配离子中同中心离子配合的离子(或分子)叫配位体。配位体是含有孤对电子的分子或阴离子,直接同中心离子结合的原子称为配位原子。配位原子主要属于周期表中Ⅴ、Ⅵ、Ⅶ三个主族元素。一个配位体可能含有一个以上的配位原子。
配合物一般可分为内界和外界两个组成部分。中心离子和配位体组成配合物的内界,在配合物的化学式中一般用方括号表示内界,方括号以外的部分为外界。例如,在[Cu(NH3)4]SO4中,四个NH3和一个Cu2+组成内界,一个SO2-4为外界。在K3[Fe(CN)6]中,六个CN-和一个F3+组成内界,三个K+为外界。
在[Pt(NH3)CL4]中,二个NH3,四个CL-和Pt4+为内界,它没有外界。
配位体按所含配位原子的数目,可分为单齿配体和多齿配体。只有一个配位原子同中心离子配合的配位体,称为单齿(或一价)配体,如F-,CL-,Br-,I-,CN-,NO-2,NO-3,NH3,H2O等。有两个以上的配位原子同时跟一个中心离子配合的配位体,统称为多齿配体,如乙二胺H2N-CH2-CH2-NH2,有两个氨基氮是配位原子。又如,乙二胺四乙酸根(-OOC-CH2)2N-CH2-CH2-N(CH2-COO-)2中,除有两个氨基氮是配位原子外,还有四个羟基氧也是配位原子。

现将常见的配位体列入表5-1。
表5-1 常见的配位体
|
配位原子 |
配位体举例 |
|
卤素 |
F-,CL-,Br-,I- |
|
O |
H2O,RCOO-,C2O2-4(草酸根离子) |
|
N |
NH3,NO(亚硝基),NH2-CH2-CH2-NH2(乙二胺) |
|
C |
CN-(氰离子) |
|
S |
SCN-(硫氰根离子) |