(二)米-曼氏方程式的推导
米-曼氏方程式提出后又经riggs和Haldane的充实和发展,经补充和发展的米-曼氏方程工推导如下:
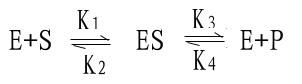 (1)
(1)
式中K1、K2、K3、K4分别为各向反应的速度常数。
从式(1)中知,ES的生成途径来自E+S和E+P,但其中E+P生成ES的速度极小(尤其在起始阶段,P的生成很少),可以忽略不计,又因为底物浓度大大超过酶的浓度,[S]》[E],中间产物ES中的S浓度可以忽略不计,因此,ES的生成速度为:
| d[ES]/dt |
= |
K1([Et]-[ES])*[S] |
(2) |
其中[Et]-[ES]为游离酶的浓度,ES的分解速度为:
|
- |
[ES]/dt |
= |
K2[ES]+K3[ES]=(K2+K3)[ES] |
(3) |
当反应体系处于稳态时,ES生成和分解的速度相等,即
K1([Et]-[ES])·[S]=(K2+K3)[ES]
|
(K2+K3)/K1 |
= |
([Et]-[ES)]/[ES] |
*[S] |
令K2+K3/K1=Km 则 Km=[Et]-[ES]/[ES]·[S]
[ES]=[Et][S]/Km+[S] (4)
由于反应速度取决于产物P的生成量,故
V=K3[ES] (5)
在酶促反应达最大速度时,所有的酶分子都已与底物结合形成中间产物,此时
[Et]=[ES] (6)
那么 Vmax=K3[Et] (7)
在(4)式两边乘以K3得:
K3·[ES]=K3·[Et][S]/Km+[S] 以(5)和(7)式代入,即:
V=Vmax[S]/Km+[S]
(三)米氏常数的意义
当反应速度为最大速度一半时,米氏方程可以变换如下:
½Vmax=Vmax[S]/Km+[S]
进一步整理可得到:
Km=[S]
可知,Km值等于酶反应速度为最大速度一半时的底物浓度。
因为Km=K2+K3/K1,当K2》K3,即ES解离成E和S的速度大大超过分离成E和P的速度时,K3可以忽略不计,此时Km值近似于ES解离常数KS,此时Km值可用来表示酶对底物的亲和力。医.学.全.在.线www.med126.com
Km=K2/K1=[E][S]/[ES]=KS
Km值愈大,酶与底物的亲和力愈小;Km值愈小,酶与底物亲和力愈大。酶与底物亲和力大,表示不需要很高的底物浓度,便可容易地达到最大反应速度。但是KS值并非在所有酶促反应中都远小于K2,所以Ks值(又称酶促反应的底物常数)和Km值的涵义不同,不能互相代替使用。
Km值是酶的特征性常数,只与酶的性质,酶所催化的底物和酶促反应条件(如温度、pH、有无抑制剂等)有关,与酶的浓度无关。酶的种类不同,Km值不同,同一种酶与不同底物作用时,Km值也不同。各种酶的Km值范围很广,大致在10-1~10-6M之间。
当K3不远远小于K2和K1时,Km表示整个反应的化学平衡的常数。
如果Km值已知,任何底物浓度时酶的饱和度(形成中间产物的酶占总酶的比例,saturation fraction fEs)fEs便可计算出来。
fES=[ES]/[Et]=K3[ES]/K3[Et]=V/Vmax=[S]/Km+[S]
(四)Km和Vmax的求法
如图2?所示,底物浓度曲线是矩形双曲线。
从图中很难精确地测出Km和Vmax。为此人们将米氏方程进行种种变换,将曲线作图转变成直线作图。
1.双倒数作图(doublereciprocal plot or LineweaverBurk plot)
将米氏方程两边取倒数,可转化为下列形式:
1/V=Km/Vmax·1/[S]+1/Vmax
从图2-10可知,1/V对1/[S]的作图得一直线,其斜率是Km/V,在纵轴上的截距为1/Vmax,横轴上的截距为-1/Km。此作图除用来求Km和Vmax值外,在研究酶的抑制作用方面还有重要价值。
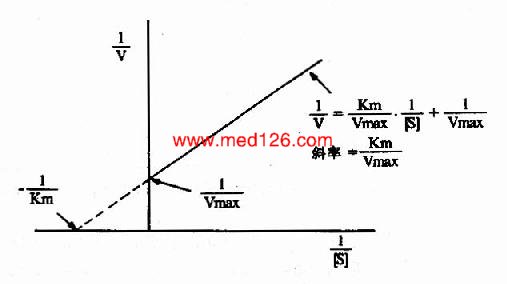
图2-10 双倒数作图法
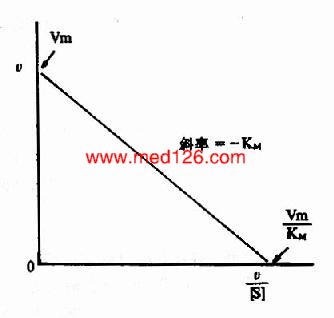
图2-11 v对v/[s]作图法
2.V对V〖〗[S][SX)]法(EadieHofstee plot)
将米氏方程经移项整理后可写成
VKm+V[S]=Vm[S]
V[S]=Vm[S]-VKm
故V=Vm-KmV/[S]
以V为纵坐标对V/[S]横坐标作图,所得直线,其纵轴的截距为Vmax,斜率为Km(图2-11)。
必须指出米氏方程只适用于较为简单的酶作用过程,对于比较复杂的酶促反应过程,如多酶体系、多底物、多产物、多中间物等,还不能全面地籍此概括和说明,必须借助于复杂的计算过程。