(二)蛋白质空间橡象与功能活性的关系
蛋白质多种多样的功能与各种蛋白质特定的空间构象密切相关,蛋白质的空间构象是其功能活性的基础,构象发生变化,其功能活性也随之改变。蛋白质变性时,由于其空间构象被破坏,故引起功能活性丧失,变性蛋白质在复性后,构象复原,活性即能恢复。
在生物体内,当某种物质特异地与蛋白质分子的某个部位结合,触发该蛋白质的构象发生一定变化,从而导致其功能活性的变化,这种现象称为蛋白质的别构效应(allostery)。
蛋白质(或酶)的别构效应,在生物体内普遍存在,这对物质代谢的调节和某些生理功能的变化都是十分重要的。
现以血红蛋白(hemoglobin,简写Hb)为例来说明构象与功能的关系。
血红蛋白是红细胞中所含有的一种结合蛋白质,它的蛋白质部分称为珠蛋白(globin),非蛋白质部分(辅基)称为血红素(见图1-14)。Hb分子由四个亚基构成,每一亚基结合一分子血红素。正常成人Hb分子的四个亚基为两条α链,两条β链。α链由141个氨基酸残基组成,β链由146个氨基酸残基组成,它们的一级结构均已确定。每一亚基都具有独立的三级结构,各肽链折叠盘曲成一定构象,β亚基中有8个α-螺旋区(分别称A、B……H螺旋区),α亚基中有7个α-螺旋区。在此基础上肽链进一步折叠形成球状,依赖侧链间形成的各种次级键维持稳定,使之球形表面为亲水区,球形向内,在E和F螺旋段间的20多个巯水氨基酸侧链构成口袋形的疏水区,辅基血红素就嵌接在其中,α亚基和β亚基构象相似,最后,四个亚基α2β2聚合成具有四级结构的Hb分子(见图1-15)。在此分子中,四个亚基沿中央轴排布四方,两α亚基沿不同方向嵌入两个β亚基间,各亚基间依多种次级健联系,使整个分子呈球形,这些次级键对于维系Hb分子空间构象有重要作用,例如在四亚基间的8对盐键(图1-16),它们的形成和断裂将使整个分子的空间构象发生变化。
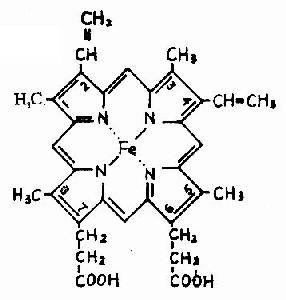
图1-14 血红素的结构式

图1-15 血红蛋白β亚基的构象
ABCDEFGH分别代表不同的α-螺旋区。共有八个螺旋区;阿拉伯数字代表在该区氨基酸残基的序号;a-螺旋区之间的移行部位为无规卷曲,用AB,CD,EF,FG…等表示。C1,E7,C5,CF,C3,E3,的中间为血红素,其中较大的黑点代表Fe2+。

图1-16 血红蛋白亚基间盐键示意图
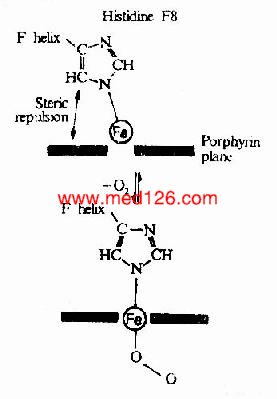
图1-7 铁原子在氧合时落入血红素平面

图1-18
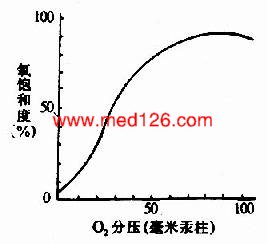
图1-19 Hb的氧饱和曲线
Hb在体内的主要功能为运输氧气,而Hb的别位效应,极有利于它在肺部与O2结合及在周围组织释放O2。
Hb是通过其辅基血红素的Fe++与氧发生可逆结合的,血红素的铁原子共有6个配位键,其中4个与血红素的吡咯环的N结合,一个与珠蛋白亚基F螺旋区的第8位组氨酸(F8)残基的咪唑基的N相连接,空着的一个配位键可与O2可逆地结合,结合物称氧合血红蛋白。
在血红素中,四个吡咯环形成一个平面,在未与氧结合时Fe++的位置高于平面0.7Å,一旦O2进入某一个α亚基的疏水“口袋”时,与Fe++的结合会使Fe++嵌入四吡咯平面中,也即向该平面内移动约0.75Å(图1-17),铁的位置的这一微小移动,牵动F8组氨酸残基连同F螺旋段的位移,再波及附近肽段构象,造成两个α亚基间盐键断裂,使亚基间结合变松,并促进第二亚基的变构并氧合,后者又促进第三亚基的氧合(图1-18)使Hb分子中第四亚基的氧合速度为第一亚基开始氧合时速度的数百倍。此种一个亚基的别构作用,促进另一亚基变构的现象,称为亚基间的协同效应(cooperativity),所以在不同氧分压下,Hb氧饱和曲线呈“S”型(图1-19)。