电解质的溶解度在每100g水中为0.1g以下的,称为微溶电解质。在一定温度下,当水中的微溶电解质MA溶解并达到饱和状态后,固体和溶解于溶液中的离子之间就达到两相之间的溶解平衡:
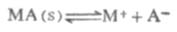
s表示固体,根据化学平衡原理:
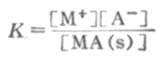
[MA(s)]是常数,可以并入常数项中,得到
[M+][A-]=K[MA(s)]=Ksp (2-8)
式(2-8)表明:在微溶电解质的饱和溶液中,温度一定时,各离子浓度幂之乘积为一常数,称为溶度积常数,简称溶度积。用符号Ksp表示。
对于MmAn型电解质来说,溶度积的公式是
[M]m[A]n= Ksp (2-9)
须注意,式(2-9)中省略了离子的电荷。
表2-7列出了一部分微溶电解质的溶度积。溶度积的大小取决于微溶电解质的本性,它随温度的升高而升稍微增大。
表2-7 一些微溶电解质的溶度积(18~25℃)
|
微溶电解质 |
Ksp |
微溶电解质 |
Ksp |
|
AgBr |
5.0×10-13 |
Ca3(PO4)2 |
2.0×10-29 |
|
AgCL |
1.8×10-10 |
Mg(OH)2 |
1.8×10-11 |
|
Ag2CrO4 |
1.1×10-12 |
Cu(OH)2 |
2.2×10-20 |
|
AgI |
8.3×10-17 |
CuS |
6.3×10-36 |
|
Ag2S |
6.3×10-50 |
Fe(OH)2 |
8.0×10-16 |
|
Al(OH)3 |
1.3×10-33 |
Fe(OH)3 |
4×10-38 |
|
BaCO3 BaSO4 |
5.1×10-9 1.1×10-10 |
HgS(红色) |
4×10-53 |
|
CaCO3 |
2.8×10-9 |
PbS |
8.0×10-28 |
|
CaF2 |
2.7×10-11 |
CaC2O4 |
4×10-9 |
溶度积和溶解度都可以表示物质的溶解能力,所以它们之间可以互相换算。知道溶解度可以求出溶度积,也可以由溶度积求溶解度。不过由于影响微溶电解质溶解度的因素很多,如同离子效应、盐效应等,所以换算往往是比较复杂的。我们只介绍不考虑这些因素时的简单换算方法。但是要注意不能把它推广应用到任意微溶电解质。
应该指出:溶度积的大小与溶解度有关,它反映了物质的溶解能力。对同类型的微溶电解质,如AgCL,AgBr,AgI,BaSO4,PbSO4,CaCO3,CaC2O4等,在相同温度下,Ksp越大,溶解度就越大;Ksp越小,溶解度就越小。对于不同类型的微溶电解质,不能认为溶度积小的,溶解度都一定小。如Ag2CrO4的溶度积(Ksp=1.1×10-12)比CaCO3的溶度积(Ksp=2.8×10-9)小,但Ag2CrO4的溶解度(6.5×10-5mol·L-1)却比CaCO3的溶解度(5.29×10-5mol·L-1)大.因此,从Ksp大小比较溶解度大小时,只有在同类型的电解质之间才能直接比较,否则要通过计算,下面举例说明溶解度和溶度积之间的换算。
例6 25℃时,AgCL的溶解度是0.00192g·L-1,求它的溶度积.
解: AgCL的相对分子质量为143.3,AgCL饱和溶液的量浓度为:
0.00192/143.3=1.34×10-5(mol·L-1)
根据AgCL在溶液中的离解:

溶液中应有 [A+]=[CL-]=1.34×10-5 mol·L-1
所以AgCL的Ksp=[A+][CL-]=(1.34×10-5)2=1.80×10-10
例7 25℃时, Ag2CrO4的溶解度是6.50×10-5mol·L-1,求它的溶度积。
解: 根据Ag2CrO4在溶液中的离解:

溶液中应有
CrO42-]=6.50*10-5=mol.L-1
[Ag+]=2*6.50*10-5=13.0*10-5mol.L-1
所以Ag2CrO4的Ksp=[Ag+]2[CrO42-]=(13.0*10-5)2*6.50*10-5=1.1*1012
例8 18℃时,Mg(OH)2的Ksp=1.8×10-11,求它的溶解度。
解: 设Mg(OH)2的溶解度为x mol·L-1,根据Mg(OH)2在溶液中的离解:
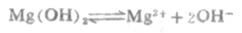
溶液中应有
[Mg2+]=χmol.L-1[OH-]=2χmol.L-1
Ksp=[Mg2+][OH-]2=χ.(zχ)2=1.8*10-11
χ=1.65*10-4(mol.L-1)