二、强酸弱碱盐溶液的PH值
一元强酸弱碱盐,例如NH4CL溶液中:
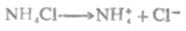
NH4+离子是NH3的共轭酸,它在水中电离:
或简写为 
CL-离子不与水电离出的H+结合,它与溶液的酸碱性无关。可认为NH4+就是酸,与水作用放出H+而使溶液显酸性。当c/Ka≥500时,可用式(2-3)计算。
 式中,c为浓盐酸的浓度。PH值可由[H+]计算。
式中,c为浓盐酸的浓度。PH值可由[H+]计算。
多元强酸弱碱盐例如(NH4)2SO4溶液中PH值的计算,与一元强酸弱碱盐的PH值计算类似。
三、两性物质溶液的PH值
(一)多元酸酸式盐溶液的PH值
多元酸酸式盐中的酸式酸根离子,例如HCO-3在水溶液中的质子转移平衡如下:
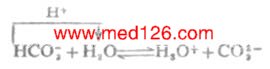 HCO-3作为酸,根据数学推导,当Ka2C>20KW,且c>20Ka1时,水的离解可以忽略,且两性物质浓度不是很稀时,HCO-3溶液中[H+]的近似计算式为
HCO-3作为酸,根据数学推导,当Ka2C>20KW,且c>20Ka1时,水的离解可以忽略,且两性物质浓度不是很稀时,HCO-3溶液中[H+]的近似计算式为
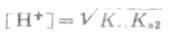 (3-9)
(3-9)
式中Ka1和Ka2分别是碳酸的一级和二级离解常数。
对于其他酸式根离子水溶液和PH值,也可以类推得到近似公式。例如对于H2PO4溶液:
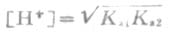
对于HPO2-4溶液

从这些近似公式可以看到,这些盐溶液的PH值与浓度无关。
例4 计算0.10mol.L-1 NaHCO3溶液的pH值。已知H2CO3的Ka1=4.30*10-7,Ka1=5.61*10-11。
解:由符合近似条件,故可用近似公式计算。

(二)、弱酸弱碱盐溶液的PH值
NH4OAc是两性物质。在溶液中,
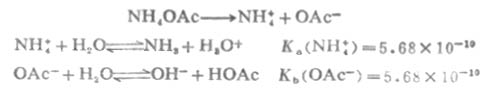
根据数学推导,当cKa(NH4+)>20Kw,且c〈20Ka(HOAc)时,计算溶液[H+]的近似公式为:
 (3-10)
(3-10)
设NH4OAc浓度为0.100mol.L-1,则
