通过对补体系统的蛋白结构进一步探查,表现了一些颇具特色的结构功能域(module),并根据它们在氨基酸序列上的同源性,将它们归为几个不同的蛋白家族。同一家族中的各个成员通常具有相类似的结构和功能。此外,根据不同补体蛋白基因间的同源性,提示每个家族的成员可能是由一个共同的祖基因复制而来,出现结构上的多样性,进而使各种补体蛋白又具有各自特定的功能。
(一)C1q与其相关的分子
C1q与其相关的分子:甘露糖结合蛋白(mannose-binding protein,MBP)、肺表面活性物质脱辅基蛋白A和D(surfactant protein A and D,SP-A,SP-D)、类风湿因子(RF)和胶固素(conglutinin)等,为具有以胶原样蛋白和凝集素区结构为特征的一组蛋白。因此有人将collagen与lectin两字缩合,归纳称为“collectin”(可暂译为胶凝素)。这些相关分子均能以抗体依赖或非依赖的方式被激活,再激活补体系统,或具有结合C1q-R的能力,从而模拟和放大C1q的功能作用。
(二)丝氨酸蛋白酶补体分子
在补体固有成分和调节蛋白中,共有6个丝氨酸蛋白酶(原)。即:C1r、Cls、C2、B因子(Bf)、D因子和I因子。它们除彼此在氨基酸序列上有同源性外,还与非补体性丝氨酸蛋白酶(如胰蛋白酶和糜蛋白酶)高度同源。但C2和Bf的催化部位比常见的丝氨酸蛋白酶约多210个氨基酸残基。在6个补体性丝氨酸蛋白酶中,C1r和C1s,C2和Bf又具有更大的相似性。
C1r和C1s均为单链长形结构,两端呈球形似哑铃状,分子量均为85kDa。二者除在C端有共同的丝氨酸蛋白酶结构功能域外,其N端有约450个氨基酸彼此同源。均含有2个拷贝的SCR和1个拷贝的EGF前体结构功能域(图5-18)。
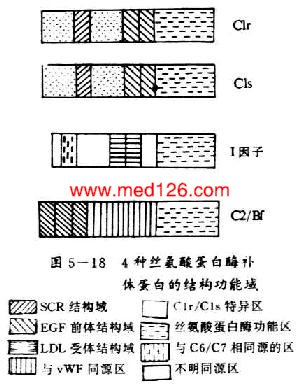
图5-18 4种丝氨酸蛋白酶补体蛋白的结构功能域
C2和Bf均为单肽链糖蛋白,它们除在形成两条补体激活途径中和C3转化酶方面十分相似外,在合成部位、合成途径、分子大小、亚单位结构、半胱氨酸位置及数目,以及保守残基替代及活性部位等方面也有很大的相似性(表5-4)。C2和Bf分子中相同的结构功能域是均有3个CSR、1个与von Willebrand因子(vWF)共同的氨基酸序列和1个丝氨酸蛋白酶结构功能域。医学全.在线提供
表5-4 C2与Bf的特性比较
| C2 | Bf | |
| 分子量 | 110kDa | 93kDa |
| C2a:75kDa | Bb:63kDa | |
| C2b:35kDa | Ba:35kDa | |
| 血清含量 | ~15mg/L | 150~200mg/L |
| 相得益彰活性部位 | C端侧(C2a) | C端侧(Bb) |
| 氨基酸 | 723 | 733 |
| C2a:509 | Bb:505 | |
| C2b:234 | Ba:234 | |
| 电镜形态 | 3个球状结构 | 3个球状结构 |
| mRNA | 2.9kb | 2.6kb |
| 基因长度 | 18kb | 6kb |
| 3个SCR | 1~65,66~127,128~186 | 4~74,75~136,137~194 |
| 形成的C3转化酶 | C42a | C3bBb |