五、计算题(70分)
1、已知:-3℃,过冷水的饱和蒸气压为489.16 Pa;-3℃,冰的饱和蒸气压为475.43 Pa,试计算-3℃、Pθ下,1mol过冷水变为冰的△G。此过程是否自发?过程中△S体、△S环以及△S孤是大于、等于还是小于零?
2、环已烷与甲基环戊烷之间有异构化作用:
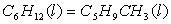
异构化反应的标准平衡常数与温度的关系为:
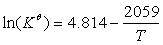
求:298K时,异构化反应的熵变?
3、273K时,用木炭吸CO气体,当CO平衡分压分别为24.0 kPa,41.2 kPa时,对应的平衡吸附量为5.567×10-3 dm•kg-1,8.668×10-3 dm•kg-1,设该吸附服从Langmuir公式。
试计算(1) 吸附系数b;(2) 当固体表面覆盖率达0.8时,CO的平衡分压是多少?
4、100℃,101325Pa时,水的蒸发热为2254J•g-1,水蒸汽的比容为1.674dm3•g-1,
(1)求在100℃时水的蒸汽压随温度的变化率dP/dT;
(2)求水在75℃时的饱和蒸气压。
5、在9.5~40℃范围内,电池 Hg | Hg2Br2 (s) | KBr (m=0.1) || KCl (m=0.1)| Hg2Cl2 (s) | Hg(l)的电动势与与温度的关系如下:E=0.1318 – 1.57710-5T(V)
(1) 计算298K时电池反应的H;
(2) 计算25℃时Hg2Br2的溶度积Ksp。已知25℃时0.1M甘汞电极的还原电极电势为0.3335V,0.1MKBr的平均活度系数为0.772,o(Hg2+/Hg)=0.789V。
6.某反应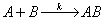 ,其机理可以表达为:
,其机理可以表达为:
(1) 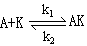
(2)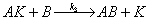 。
。
其中(1)的反应为快速平衡,(2)的反应为慢步骤,AK非常活泼。请应用稳态处理方法推导出反应速率方程 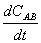 的表达式。
的表达式。