二、电极电位的产生
用导线将原电池的两个电极联接起来,其间有电流通过。这表明两个电极之间存在电位差。下面简单介绍金属及其盐溶液之间相界面上电位差是怎样产生的。
金属晶体是由金属原子、金属离子和自由电子组成的。当把金属插入其盐溶液中时,金属表面的离子与溶液中极性水分子相互吸引而发生水化作用。这种水化作用可使金属表面上部分金属离子进入溶液而把电子留在金属表面上,这是金属溶解过程。金属越活泼,溶液越稀,金属溶解的倾向越大。另一方面,溶液中的金属离子有可能碰撞金属表面,从金属表面上得到电子,还原为金属原子沉积在金属表面上。这个过程为金属离子的沉积。金属越不活泼,溶液浓度越大,金属离子沉积的倾向越大。当金属的溶解速度和金属离子的沉积速度相等时,达到了动态平衡。
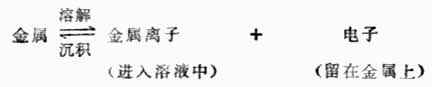
在一给定浓度的溶液中,若金属失去电子的溶解速度大于金属离子得到 电子的沉积速度,达到平衡时,金属带负电,溶液带正电。溶液中的金属离子并不是均匀分布的,由于静电吸引,较多地集中在金属表面附近的液层中。这样在金属和溶液的界面上形成了双电层(图6-2(a)),产生电位差。反之,如果金属离子的沉积速度大于金属的溶解速度,达到平衡时,金属带正电,溶液带负电。金属和溶液的界面上也形成双电层(图6-2(b)),产生电位差。金属与其盐溶液界面上的电位差称为金属的电极电位,常用符号 表示。
表示。
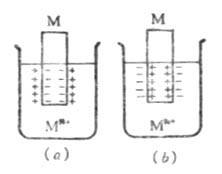
图6-2 双电层
金属与溶液间电位差的大小,取决于金属的性质,溶液中离子的尝试和温度。金属越活泼,电位越低;越不活泼,电位越高。在同一种金属电极中,金属离子浓度越大,电位越高,浓度越小,电位越低。温度越高,电位越高,温度越低,电位越低。
三、电极电位的测定
(一)标准氢电极
电极电位的绝对值是无法测定的,但可以选定一个电极作为标准,将各种待测电极与它相比较,就可得到各种电极的电极电位相对值。国际纯粹和应用化学协会(IUPAC)选定“标准氢电极”作为比较标准。
标准氢电极是氢离子浓度为1mol·L-1氢气的压力为101.325kPa的电极。国际上规定,298K 时,标准氢电极的电极电位为零。用符号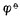 H+/H2=0表示。其电极书写为:
H+/H2=0表示。其电极书写为:
H+(1mol.L-1),H2(101.325kPa)│Pt
标准氢电极的装置如图6-3所示。容器中装有H+浓度为1mol·L-1的硫酸溶液,插入一铂片。为了增大吸附氢气的能力,铂片表面上镀一层疏松的铂(铂黑0。在298k 时,不断从套管的支管中通入压力为101.325 kPa的纯氢气,H2被铂黑吸附直到饱和.这时整个铂黑片仿佛是由氢气组成,铂黑吸咐的H2和溶液中的H+构成了氢电极,其电极反应为;


图6-3 标准氢气电极