(二)有关能斯特方程式的计算
1.计算电极电位
利用能斯特方程式,可以计算不同条件下的电极电位值。
例4 计算298K,锌离子浓度为0.01mol.L-1时,Zn2+│Zn电极的电极电位。
解:电极反应
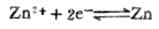 已知n=2,[Zn2+]=0.01mol.L-1,
已知n=2,[Zn2+]=0.01mol.L-1,  (Zn2+/Zn)=-0.7628V,则,
(Zn2+/Zn)=-0.7628V,则,
 =-0.7628-0.05916
=-0.7628-0.05916
=-0.822(V)
在此例中,由于[Zn2+]<1mol.L-1,所以 
 。若金属离子浓度愈小,则金属的电极电位愈低表明还原剂失电子的倾向增强了。
。若金属离子浓度愈小,则金属的电极电位愈低表明还原剂失电子的倾向增强了。
例5 计算298K时,Pt│Fe3+(mol.L-1),Fe2+(0.001mol.L-1)电极的电极电位。
解: 电极反应:
 已知n=1,[Fe3+]=1mol.L-1,[Fe2+]=0.0001mol.L-1,
已知n=1,[Fe3+]=1mol.L-1,[Fe2+]=0.0001mol.L-1, (Fe3+/Fe2+)=0.77V,则
(Fe3+/Fe2+)=0.77V,则
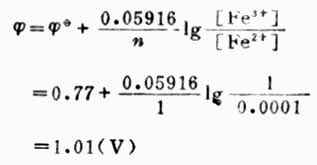
从本例中可以看出,氧化型离子浓度愈大,或还原型离子愈小,电极电位愈高,表明氧化型得电子的倾向愈大。也就是说电极电位随着氧化型物质浓度增大而升高,随着还原型物质浓度增大而降低。
例6 求电极反应
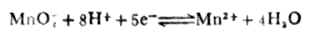
在pH=5溶液中的电极电位(其他条件同标准状态)。
解:已知n=5,[MnO4+-]=[Mn2+]=1mol.L-1,[H+]=10-5mol.L-1,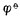 (MnO4-/Mn2+)=+1.491V,则
(MnO4-/Mn2+)=+1.491V,则
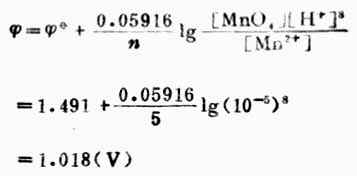
计算结果表明,[H+]降低,对应的氧化型物质(MnO4-)的氧化能力降低。
2.判断原电池的正、负极,计算电动势
通常组成原电池的各有关物质并不是处于标准状态。计算原电池的电动势,首先根据标准电极电位表,利用能斯特方程计算出标准状态下各电极的电极电位。然后根据电极电位的高低判断正、负极,把电极电位高的电极作正极,电极电位低的电极作负极。正极的电极电位减去负极的电极电位即得原电池的电动势。
例7 计算298K时,电池Cu│Cu2+(0.1mol.L-1)‖Fe2+(0.1mol.L-1);Pt的电动势,并说明它是否按惯例书写正负极,列出电池反应式。
解:从表6-1中查出电极反应式及标准电极电位:
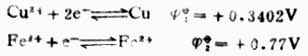
根据能斯特方程式,分别计算它们在非标准状态下的电极电位。

计算结果表明,电池右侧是正极,左侧是负极。该原电池是按惯例书写的。原电池的电动势为:
E=  右-
右- 左=0.83-0.31=0.52(V)
左=0.83-0.31=0.52(V)
电极反应 负极 Cu→Cu2++2e-(氧化反应)
正极 Fe3++e- →Fe2+(还原反应)
电池反应 Cu+2Fe3+→Cu2++2Fe2+
例8 计算298K时,电池Pt│I2,I-(0.1mol.L-1)‖MnO4-(0.1mol.L-1),Mn2+(0.1mol.L-1),H+(0.01mol.L-1)│Pt的电动势并写出电池反应式。
解:由表6-1中查出电极反应式及标准电极电位:
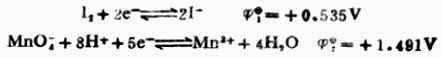 根据能斯特方程式,分别计算非标准状态下的电极电位。
根据能斯特方程式,分别计算非标准状态下的电极电位。

计算表明,电池右侧电极的电极电位高为正极,左侧电极电位低为负极。所以,
E=  右-
右- 左=1.195-0.594
左=1.195-0.594
=0.601(V)
电极反应 2I-→I2+2e- (氧化反应)
正极MnO-4+8H+ +5e-→Mn2++4H2o (还原反应)
电池反应 2MnO-4+10I-+16H+ →2Mn2++5I2+8H2O