(二)标准电极电位的测定
参与电极反应的各有关物质均为标准状态(离子浓度为1mol·L-1,气体物质的分压为101.325 kPa)时,其电极电位称为该 电极的标准电极电位,用符号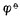 表示。欲测定某标准电极的电位,可将该电极与标准氢电极组成原电池,书写时把标准氢电极列于左侧(假定为负极),将待测电极列于右侧(假定为正极)。用电位计测定该原电池的标准电动势 Eφ,则有
表示。欲测定某标准电极的电位,可将该电极与标准氢电极组成原电池,书写时把标准氢电极列于左侧(假定为负极),将待测电极列于右侧(假定为正极)。用电位计测定该原电池的标准电动势 Eφ,则有
Eφ=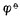 右-
右-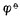 左=
左=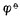 侍测-
侍测- H+/H2
H+/H2
例2测定Zn 2+│Zn电极的标准电位, Zn2+/Zn。
Zn2+/Zn。
解:将标准Zn2+│Zn电极与标准氢电极组成原电池。
Pt│H2(101.325kPa),H+(1mol.L-1)‖Zn2+(1mol.L-1)│Zn
298K时,测得Eφ=-0.7628(V)。
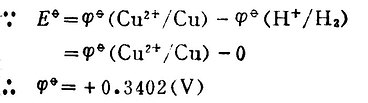
因为Zn 2+│Zn电极的电位为负值,低于标准氢电极的电位。所以Zn 2+│Zn是极为负极,标准氢电极为正极。其电极反应和电池反应为:
电极反应 负极Zn→Zn 2++2e-
正极2H++2e-→H2
电池反应 Zn+2H+→Zn 2++H2
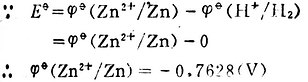
例3 测定Cu2+│Cu电极的标准电极电位, 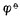 Cu2+/Cu。
Cu2+/Cu。
解:将标准Cu2+│Cu电极与标准氢电极组成原电池。
Pt│H2(101.325kPa),H+(1mol.L-1)‖Cu2+(1mol.L-1)│Cu
298K时,测得Eφ=+0.3402(V)。
因为Cu2+│Cu电极的电位为正值,高于标准氢电极的电位。所以Cu2+│Cu电极,标准氢电极为负极。其电极反应和电池反应为,
电极反应 负极H2→2H++2e-
正极Cu2++2e-→Cu
电池反应 H2+Cu2+→2H++Cu
(三)标准电极电位表
用上述方法不仅可以测定金属的标准电极电位,也可测定非金属离子和气体的标准电极电位。对于某些与水剧烈反应而不能直接测定的电极,可以通过热力学数据用间接的方法计算出标准电极电位。表6-1列出了298k 时,一些物质在水溶液中的标准电极电位。
为了正确使用标准电极电位表,将有关问题概述如下:
1.在电极反应式氧化型  还原型中,ne表示电极反应的电子数。氧
还原型中,ne表示电极反应的电子数。氧
化型和还原型包括电极反应所需的H+,OH-,H2O等物质,如
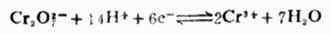 氧化型与还原型是相互依存的。同一种物质在某一电对中是氧化型,在另一电对中也可以是还原型。例如,
氧化型与还原型是相互依存的。同一种物质在某一电对中是氧化型,在另一电对中也可以是还原型。例如,

中是氧化型,在
 (
( 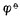 =0.77V)
=0.77V)
中是还原型。所以在讨论与Fe2+有关的氧化还原反应时,若Fe2+是作为还原剂而被氧化为Fe3+,则必须用与还原型的Fe2+相对应的电对的  值(0.77V)。反之,若Fe2+是作为氧化剂而被还原为Fe,则必须用与氧化型的Fe2+相对应的电对的
值(0.77V)。反之,若Fe2+是作为氧化剂而被还原为Fe,则必须用与氧化型的Fe2+相对应的电对的 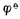 值(-0.88V)。
值(-0.88V)。
2.表6-1采用的电位是还原电位。不论电极进行氧化或还原反应,电极电位符号不改变。例如,不管电极反应是Zn→Zn2++2e-还是Zn2++2e-→Zn,Zn2+ │Zn电极标准电极电位值均取-0.7628V。 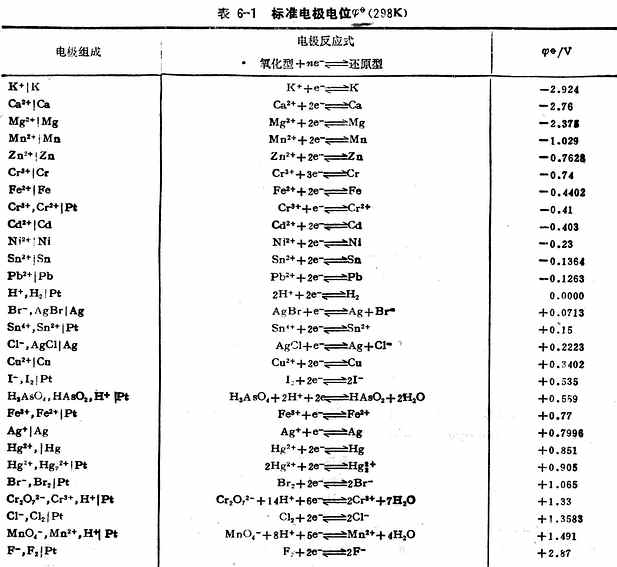
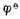 愈高,表示该电对的氧化型愈容易接受电子,氧化其它物质的能力愈强,它本身易被还原,是一个强氧化剂,而它的还原能力愈弱;
愈高,表示该电对的氧化型愈容易接受电子,氧化其它物质的能力愈强,它本身易被还原,是一个强氧化剂,而它的还原能力愈弱;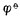 愈低,表示该电对的还原型愈容易放出电子,还原其它物质的能力愈强,它本身易被氧化,是一个强还原剂,而它的氧化型的氧化能力愈弱。
愈低,表示该电对的还原型愈容易放出电子,还原其它物质的能力愈强,它本身易被氧化,是一个强还原剂,而它的氧化型的氧化能力愈弱。
电极反应式左方的氧化型可作氧化剂,右方的还原型可作还原剂。氧化型在表的愈下方就是愈强的氧化剂;还原型在表的愈上方就是愈强的还原剂。因此,在不同的氧化剂或在不同的还原剂之间进行强弱比较时,根据标准电极电位的数值可以明确地判断它们的强弱。例如,在表上所列的各物质中,F2是最强的氧化剂,k 是最强的还原剂。
4.标准电极电位  值与电极反应中物质的计量系数无关。例如,Ag+│Ag电极的电极反应写成,若写成。?
值与电极反应中物质的计量系数无关。例如,Ag+│Ag电极的电极反应写成,若写成。?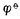 (Ag+/Ag)仍是+0.7996V,而不是2*0.7996V.
(Ag+/Ag)仍是+0.7996V,而不是2*0.7996V.
5.电极电位和标准电极电位,都是电极处于平衡状态时表现时出来的特征,它和达到平衡的快慢无关。
根据上面所述,在标准状态下,由任何两个电极(半电极)组成电池时,电极电位较高的一方,由于有较强的氧化剂,起还原作用为正极;电极电位较低的一方,由于有较强的还原剂,起氧化作用为负极。
四、影响电极电位的因素
(一)能斯特(Nernst)方程式
一个电极的电极电位的大小与温度、浓度间的关系可用能斯特方程式表示:
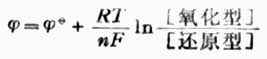 (6-2)
(6-2)
式中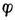 ——电极电位,单位为V
——电极电位,单位为V
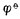 ——标准电极电位,单位为V
——标准电极电位,单位为V
R——气体常数,8.314J-1.Kmol-1
F——法拉弟常数,96490C.mol-1
T——绝对温度,K
n——电极反应得失的电子数
当温度为298K时,将各常数值代入式(6-2),并将自然对数转换成常用对数,能斯特方程式可改写为:
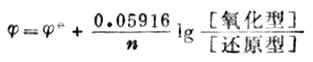 (6-3)
(6-3)
应用能斯特方程式时,应注意以下几点:
1.若电极反应式中有纯固体、纯液体或介质水时,它们的浓度不列入方程式中;气体物质用分压,即101.325kPa的倍数表示。
2.若电极反应式中氧化型、还原型物质前的系数不等于1时,则在方程式中它们的浓度项应以对应的系数为指数。
3. 氧化型、还原型物质包括与它们同存在的有关物质。例如, ,[氧化型]=[MnO4-][H+]8。