Angerer及其同事们首先应用RNA探针于原位杂交(见Cox et al 1984),核酸探针为单链的RNA分子,产生自具有质粒逆转录系统的cDNA克隆(图20-2)。由于它是单链的,不像双链的DNA探针,在溶液中不会再退火(reanneal),因此,较大百分比的探针可参与杂交反应,较cDNA探针的信号强。除此之外,在溶液中产生的cRNA-mRNA杂交体比相应的cDNA-mRNA杂交体稳定,但在原位杂交中是否如此尚未证明。cRNA探针不足之处在于有时比DNA探针粘性强(stickier)。可与组织产生较高的非特异性结合,但此缺陷可在杂交后漂洗液中加用酶漂洗来解决。最近,Wolf等(1987)建议插入确定长度的寡核苷酸至载体内产生cRNA分子,这种cRBA分子称为“寡核苷酸核酸探针”(oligoribo-probes)已被成功的用于原位杂交实验。
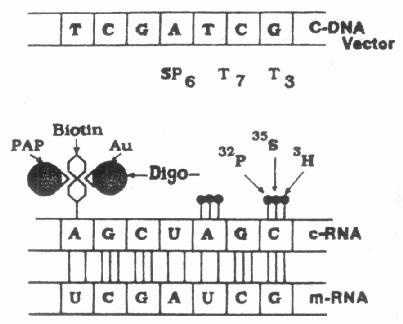
图20-2 示cDNA转录为cRNA,可标记以不同的标记物,然后与细胞中
的mRNA相结合。Biotin(生物素),Au(金),digo-(地高辛)
一、同位素标记cRNA探针在ISHH中的应用
(一)组织切片的原位杂交细胞化学方法
(1)组织准备:大鼠以10%水合氯醛(0.3ml/100g 体重),或1%戊巴比妥钠约1ml(3~4mg/100g体重)腹腔内注射麻醉,用100ml生理盐水冲洗和150ml 4%多聚甲醛主动脉灌注固定。固定半小时后,取出组织块,置入4%多聚甲醛液中后固定4~6h,4℃。医学.全.在线.网.站.提供
如要取脑组织,可于灌注后置4℃冰箱内过夜,次晨取脑组织,后固定4℃4h左右。
(2)组织切片/培养细胞在经过处理,抹以粘附剂的载片上,在43℃烤箱过夜。
(3)在PBS(0.1mol/l Ph7.2)中浸5~10min。
(4)浸于0.1mol/L甘氨酸—PBs 液内5min。
(5)为增强组织通透性,将载片置于0.3%Triton X-100(在PBS内)10~15min。
(6)PBS洗3×5min。
(7)在蛋白激酶K(1μg/ml)溶于Tris –HCl (0.1mol/L, pH8.0)和EDTA(50mmol/L,pH8)中37℃20min。也有用蛋白激酶K溶液,不加EDTA的。
(8)浸入新鲜配制的4%多聚甲醛(在PBS0.1mokl/L,pH7.2)3min以终止消化作用和再固定。
(9)浸入新鲜配制的含0.25%(V/V)三乙醇胺(0.1mol/l pH8.0)中,10min以达乙酰化(acetylate)的目的。
(10)预杂交:在50%(V/V)甲酰胺溶于4×SSC预热37℃15~45min 。
(11)杂交:将载片上过量的甲酰胺液倾去,加20μl杂交混合液(含放射性同位素标记的探针量为5×103~106cpm/每张载片)。覆以硅化的盖玻片,置于盛有少量5×SSC的硬塑料盒内以保持湿度,42℃孵育12~18h。为使载片不致于浸泡于SSC溶液内,通常以二根玻管(或棒)扎成担架状,载片置于玻棒上,与盐液不接触,但可保持盒内空气湿润。
(12)杂交后漂洗
①以小烧杯盛适量4×SSC溶液,将载片一端斜插入溶液内,轻轻抖动以移除盖玻片。
②将载片置于有刻度的染色用小方玻缸内,加入42℃(预热)4×SSC,3×20min。在漂洗过程中宜不断振动,以增强漂洗效果。如设有调整钮的振动台更为理想。
③加20μlRNA酶溶液(20μg/ml)在NaCl(0.5mol/L)、Tris –HCl (pH8.0)和EDTA(1mmol/L,pH8.0)消化未杂交探针,42℃30min(也有不加EDTA的)。
④以递减梯度盐溶液SSC漂洗载片:2×SSC,0.1×SSC和0.05×SSC各30min 42℃。
⑤梯度酒精脱水:70%,90%,2×100%酒精含0.3mol/L乙酰胺,室温,每次10min,空气干燥后待进行放射自显影。
(13)放射自显影和复染
①在暗室中预热水浴至45℃,将分装的核乳胶溶液小瓶置水浴中浸泡至少1h,同时预热一电热板至45℃。将杂交后漂洗过完全干燥的载片依次排列于玻片架上,有组织切片一面面向实验者。在实验的载玻片前放1~2张无切片的干净玻片,作为测定核乳胶溶解度与浸片高度等的空白对照片。浸泡(Dipping)过核乳胶膜的载片放入暗盒内,事先最好将暗盒准备好,为保持干燥,放入一包变色硅胶干燥剂(无水干燥剂为小块蓝色晶体,吸水后呈粉红色,置烤箱中烘干待转成蓝色后可重复应用),预先备好封固暗盒用的胶带备用。
②核乳胶液,国外产品为ILFord K5乳胶液,国内核乳胶产品可自原子能研究所订购。不论国产或进口乳胶,事先应(按说明需要浓度)稀释分装在10ml小瓶内,密封于暗盒内,4℃备用。反复的冷冻和融解核乳胶会增加背景染色。每一小瓶供一次性实验应用。
为节 省核乳胶,切片宜贴附在靠近载片的一端。这样,在浸泡时少量乳胶便可充分覆盖切片。
③浸核乳胶(Dipping):当一切准备工作就绪后,在暗室中(只留完全灯)先将载片置于电热板上预热1~2min。以空白载片浸入核乳胶液,取出后检查核乳胶是否充分溶解,玻片上有无气泡。然后正式进行切片浸入。浸核乳胶膜是一项需反复操练的技术。以拇、食指夹住玻片一端,以垂直方向进入乳胶,进入的提出均应采取中速度,且速度应保持稳定,提出后可将玻片一端滴下的乳胶轻沾于吸水纸上,掌握好该技术,浸入形成的核乳胶膜厚度适当,均匀一致。依序放在预热45℃的电热板,倾斜度应一致。在45℃电热板上干燥至少1~2h,在此期间应严格控制在黑暗中。
④装入暗盒曝光:将载片架上已干燥覆有核乳胶的载片放入暗盒内,周围用胶带封固,以标签写明:样品种类,实验者姓名,曝光日期等放在4℃冷房或冰箱内。曝光时间依同位素种类而异,32P大约需5~7日,3H需4周,但还要参考细胞内mRNA的含量而定,含量高者曝光时间宜短,反之宜适当延长。可根据不同曝光时间的实验结果予以调整。曝光时间长可增加信号,但也增加背景,反之,信号减弱,但背景亦低。
⑤显影:取出切片中暗盒(注意:切勿启封),放在室温至少1h,使其回升到室温。然后在暗室内(只留安全灯),将载片置入Kodax D19显影液(预调温至18~20℃)3min。水冲片刻后入Kodax F24固定剂内3min。上述溶液及水温最好都保持在18~20℃。突然改变溶液温度会损坏精细的核乳胶膜。另外,在显影和定影过程中不要振荡溶液,因为,这时的乳胶还是处于胶状结构,溶液振荡的冲击可使乳胶膜产生划痕。
⑥冲洗,脱水和复染:用自来水(水冲力勿过猛)冲洗载片20min,如需要可用1%苏木精复染,复染后自来水冲洗分化2min,梯度酒精脱水(70%,90%,100%)每次3min,二甲苯透明,DPX封片。