发病机理
红细胞过早地被破坏可以发生在血管外或血管内。血管外溶血(extravascular hemolysis)即红细胞被脾、肝中的巨噬细胞(单核一巨噬细胞系统)吞噬后破坏。血管内溶血(intravascular hemolysis)是红细胞直接在血循环中破裂,红细胞的内容(血红蛋白)直接被释放入血浆。
一、血管外溶血
红细胞在巨噬细胞中破坏后,血红蛋白被释放出来,就在巨噬细胞内分解成珠蛋白(globin)和血红素(hematin),血红素分解为铁,一氧化碳,碳氧血红蛋白(Carboxyhemoglobin),胆绿素(biliverdin),后者最后变成胆红素(bilirubin)被血浆运至肝脏。在肝内,胆红素与葡萄糖醛酸结合为直接胆红素。未与葡萄糖醛酸结合的胆红素称间接胆红素。胆红素与葡萄糖结合为直接胆红素。未与葡萄糖醛酸结合的胆红素称间接胆红素。胆红素葡萄糖醛酸复合物经胆汁排入小肠,分解为粪尿胆原。粪尿胆原可被吸收入血液而从尿内排出。血管外溶血可发生于脾、肝或骨髓的巨噬细胞。脾脏能最有效地清除有轻微损伤的红细胞,因在脾索中有独特的循环结构。肝脏血流量超过脾脏血流量,它是除去和吞噬广泛损伤红细胞的重要部位。IgM和补体二者致敏的红细胞,很容易在肝脏被有C3b受体的肝巨噬细胞除去。反之,IgM致敏而没有补体成分附着的红细胞,其生存期正常,因为巨噬细胞没有IgG致敏的红细胞,可激活或不激活补体,因红细胞表面IgG的许多分子只与一个补体分子结合。而IgG致敏的红细胞,即使没有补体也能被巨噬细胞清除。IgG致敏的红细胞主要在脾脏被巨噬细胞(有IgG-Fe受体,还有C3b受体)清除。IgG和补体二者同时致敏的红细胞的清除较迅速,因为吞噬作用受二种受体介导。所以血管外溶血的部位和程度决定于抗体的种类和有无补体存在。骨髓巨噬细胞清除有内在异常的成熟的前体细胞,导致无效红细胞生成,如地中海贫血和巨幼细胞性贫血。遗传性红细胞膜、血红蛋白和细胞内酶缺陷等伴发的溶血性贫血,都有一定程度的无效红细胞生成。
二、血管内溶血
发生血管内溶血时,血红蛋白直接被释放入血浆,与血浆中的结合珠蛋白(haptoglobin)―一种α2糖蛋白一结合,由于其分子较大,故不被肾脏排泄而被肝细胞摄取,最后变成胆红素。溶血较多时血浆中结合珠蛋白的浓度显著降低或消失,不过血浆中结合珠蛋白浓度的高低也受到其他多种因素的影响。
当血浆内结合珠蛋白全部与血红蛋白结合后,从游离血红蛋白分解出的血红素能与血结素(hemopexin)-一种β糖蛋白-结合,然后也被肝细胞摄取。大量溶血时血浆血结素的浓度亦降低。
血浆中的游离血红蛋白被氧化成高铁血红蛋白(methemoglobin),再分解为高铁血红素(methematin),然后与血浆中白蛋白结合成高铁血红白蛋白(methemalbumin),最后与血结素结合而被细胞摄取。血浆如有较多游离的血红蛋白,血浆可呈粉红色,但由于高铁血红白蛋白呈棕色,高铁血红蛋白呈褐色,因此其粉红色被掩盖而不易看出。
当血浆中的蛋白质与血红蛋白的结合已达饱和时,未结合的血红蛋白由于分子较小(分子量66000)出现于尿内,使尿色变红。高铁血红蛋白亦可出现于尿内,使尿呈褐色,高铁血红白蛋白由于分子大、不出现于尿内。
尿中血红蛋白被肾小管上皮吸收后分解的铁以铁蛋白及含铁血黄素的形式贮积于肾小管上皮细胞内,随上皮细胞脱落而自尿排出,以尿沉渣作亚铁氰化钾染色,可见到上皮细胞内有蓝色的含铁血黄素颗粒,含铁血黄素尿常出现于慢性血管内溶血,如阵发性睡眠性血红蛋白尿及机械性溶血性贫血。
红细胞破坏后血红蛋白发生的一系列代谢改变见图5-2-5。
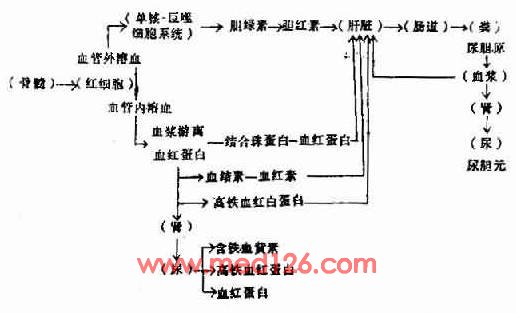
图5-2-5 溶血后血红蛋白代谢的途径